研究内容
Borderline Resectable 膵癌を対象とした術前ゲムシタビン+ナブパクリタキセル療法と術前S−1併用放射線療法のランダム化比較試験(GABARNANCE試験/JASPAC07/EPOC A1601)
研究の概要
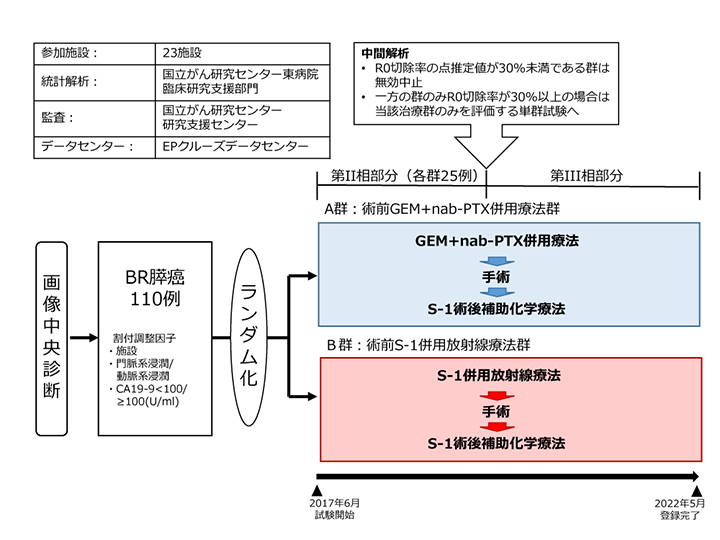
目的
Borderline resectable膵癌(以下BR膵癌)に対する2つのみなし標準治療である術前補助治療としてのゲムシタビン+ナブパクリタキセル併用療法(以下GEM+nab-PTX療法)とS-1併用放射線療法の有効性と安全性を第II/III相ランダム化比較試験により検証する。
第II相部分
Primary endpoint:
各群のR0切除割合(群間比較は行わない)
Secondary endpoint :
有害事象発生割合
第III相部分
Primary endpoint:
全生存期間
Secondary endpoints:
無増悪生存期間、R0切除割合、2年生存割合、画像診断による奏効割合、組織学的奏効割合、有害事象発生割合、プロトコール治療、コンプライアンス(術前治療完了割合、全プロトコール治療完了割合)
対象
- 画像中央診断による中央判定においてBR膵癌と確認されている。
- 病理学的に組織診断もしくは細胞診にて腺癌または腺扁平上皮癌であることが確認されている(膵癌取扱い規約第7版に基づく)。
- 膵癌取扱い規約第7版においてM1に該当する遠隔転移を画像上認めない。
- 登録時の年齢が20歳以上79歳以下である。
- Performance Status(ECOG)が0、1のいずれかである。
- 腹部に放射線治療歴がない。
- 3年以内の化学療法の治療歴がない。
- 初回治療例(膵癌に対する治療歴がない)である。
- 胸腹部CTにて、原発巣とリンパ節転移をすべて10cm×10cmの照射野に含めることが可能であると放射線治療医が判断している(PETが実施されている場合はPET陽性リンパ節も含める)。
- 経口摂取が可能である。
- 末梢性感覚ニューロパチー、末梢性運動ニューロパチーのいずれも認めない。
- 閉塞性黄疸を有する症例の場合、適切なドレナージが施行されている。
- CT等の画像所見にて内腔に突出する消化管浸潤所見やそれに伴う消化管出血の既往がない。
- 登録前7日以内の最新の検査値(登録日の1週間前の同一曜日は可)が、以下のすべてを満たす。
- ① 白血球数 ≧3,000/mm3
- ② ヘモグロビン≧9.0 g/dL(ただし登録前7日以内に輸血を行っていないこと)
- ③ 血小板数≧10×104/mm3
- ④ アルブミン ≧3.0 g/dL
- ⑤ 総ビリルビン≦2.0 mg/dL(減黄処置の有無に関わらない)
- ⑥ AST≦100 U/L(減黄処置の有無に関わらない)
- ⑦ ALT≦100 U/L(減黄処置の有無に関わらない)
- ⑧ 血清クレアチニン≦1.2 mg/dL
- ⑨ クレアチニンクリアランス50 ml/min 以上
- 試験参加について患者本人から文書で同意が得られている。
Borderline resectable膵癌の定義
遠隔転移が無く、かつ以下の①-④のいずれかまたは複数の条件を満たし、切除不能膵癌の条件を有さない。
- ① 門脈・上腸間膜静脈に180度以上の浸潤を認め、かつその範囲が十二指腸下縁を超えない。
- 再建可能な門脈・上腸間膜静脈閉塞はBorderline resectable膵癌とする。
- 腫瘍栓による門脈・上腸間膜静脈閉塞は切除不能膵癌とする。
- ② 上腸間膜動脈に腫瘍が180度未満の範囲で接しているが、変形や狭窄を認めない。
- 第2空腸動脈より足側に進展する病変は切除不能膵癌とする。
- ③ 総肝動脈に腫瘍が180度未満の範囲で接しているが、変形や狭窄がなく、固有肝動脈や腹腔動脈へ接触を認めない膵頭部癌。
- ④ 腹腔動脈、総肝動脈、もしくはその双方に腫瘍が180度未満の範囲で接するが、変形や狭窄を認めない膵体部もしくは膵体尾部癌。
- 大動脈に接触もしくは浸潤する病変は切除不能膵癌とする。
プロトコール治療
- 術前補助療法
- A群:
- GEM+nab-PTX療法
- GEM:1000 mg/m2
- nab-PTX: 125 mg/m2
- 合計6回投与を行う。
- B群:
- S-1併用放射線療法
- S-1: 80 mg/m2/day
- 放射線療法:50.4Gy/28 fraction
- 手術療法
- A群もしくはB群の術前補助療法後終了日より15日以降、56日以内に外科切除を実施する。
- 術後補助化学療法
- 術後補助化学療法は、術後14日(2週)から84日(12週)までに開始する。
- 術後補助化学療法は、原則として、S-1単独療法(80 mg/m2/day 4週投与2週休薬)を4コース施行する。154日を超えて術後補助化学療S-1療法を行う。
予定登録数と研究期間
| 登録予定数: | 110例 |
| 登録期間: | 5年 |
| 追跡期間: | 2.5年 |
| 総研究期間: | 7.5年 |
| 臨床研究の開始日 | 2017年3月16日 |
| 臨床研究の終了予定日 | 2024年9月15日 |


